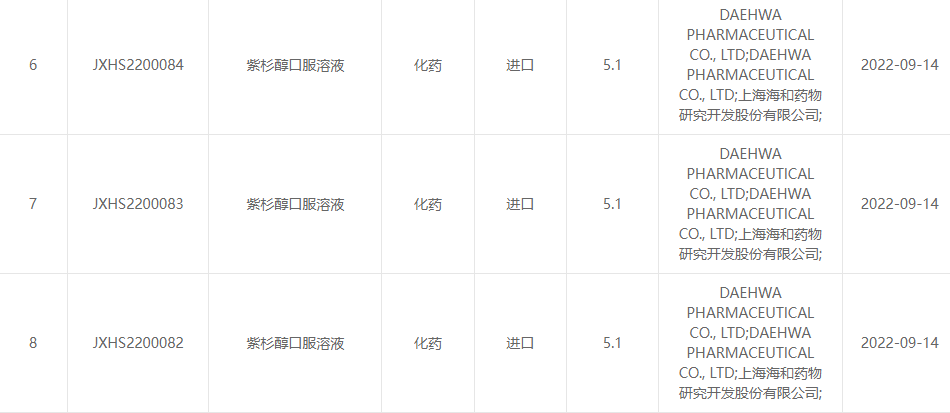
O 13 de setembro de 2022, Shanghai Haihe Pharmaceutical Research and Development Co., Ltd. e Daehwa Pharmaceutical Co., Ltd. anunciaron conxuntamente que a solución oral de paclitaxel (RMX3001) desenvolvida conxuntamente polas dúas partes foi aprobada oficialmente polo Centro de Drogas. Avaliación (CDE) da Administración Estatal de Drogas.(Número de aceptación: país JXHS2200082, país JXHS2200083, país JXHS2200084).
Fonte da imaxe: State Drug Administration
Paclitaxelúsase amplamente no tratamento de varios tumores malignos como cancro de pulmón, cancro de mama, cancro de ovario, cancro de cabeza e pescozo e cancro gástrico.Polimerización de proteínas, ensamblaxe de microtúbulos, previndo a despolimerización, estabilizando así os microtúbulos e inhibindo a mitose das células cancerosas e desencadeando a apoptose, evitando así eficazmente a proliferación de células canceríxenas e exercendo un efecto anticanceroso.
Na actualidade, a maioría das partes do mundo usan paclitaxel en forma de inxección, que debe ser formulada e administrada por goteo intravenoso no hospital.Os pacientes deben volver ao hospital con frecuencia e haberá reaccións adversas no lugar da inxección.Polo tanto, o desenvolvemento de preparados de paclitaxel orais sempre foi un punto quente na investigación da industria..
RMX3001 é unha formulación oral de paclitaxel desenvolvida por Dahua Pharmaceutical baseada na súa innovadora tecnoloxía de administración de fármacos autoemulsionantes de lípidos.Foi aprobado pola Administración de Drogas e Alimentos de Corea en setembro de 2016 (nome comercial Liporaxel) e a indicación é o tratamento avanzado ou de segunda liña do cancro gástrico metastásico ou do cancro gástrico recorrente localmente.Segundo un comunicado de prensa de Haihe Pharmaceuticals, Liporaxel é o primeiro produto de paclitaxel oral que foi desenvolvido e aprobado con éxito para a comercialización no mundo ata o momento.En setembro de 2017, Haihe Pharmaceutical obtivo os dereitos de I+D, produción e venda do produto na China continental, Hong Kong, Taiwán e Tailandia de Dahua Pharmaceuticals.
A aplicación de listado de RMX3001 en China baséase principalmente nun ensaio clínico de fase 3 multicéntrico, aleatorizado, de etiqueta aberta, controlado en paralelo e de non inferioridade, que ten como obxectivo comparar o tratamento de segunda liña da solución oral de paclitaxel RMX3001 e inxección de paclitaxel (Taxol) Eficacia e seguridade en pacientes con cancro gástrico avanzado.O estudo foi realizado conxuntamente polo profesor Li Jin do Hospital Oriental de Shanghai e o profesor Qin Shukui do Hospital Jinling de Nanjing como investigadores principais.
O doutor Ruiping Dong, director xeral de Haihe Pharmaceuticals, dixo: "A aceptación da solicitude de solución oral de paclitaxel (RMX3001) é outro fito importante para Haihe Pharmaceuticals, e estou moi agradecido aos investigadores clínicos e aos pacientes que participaron no noso xuízo.Cancro gástrico avanzado Aínda hai unha enorme necesidade clínica non satisfeita de tratamento, e esperamos achegar canto antes os tratamentos innovadores e cómodos máis avanzados do mundo aos pacientes en China e en todo o mundo.
Yunnan Hande Biotechnology Co., Ltd leva 28 anos centrándose na produción de paclitaxel.É o primeiro fabricante independente do mundo do paclitaxel, un fármaco anticanceríxeno derivado de plantas, que foi aprobado pola FDA dos Estados Unidos, a EDQM europea, a TGA de Australia, a CFDA de China, a India, o Xapón e outras axencias reguladoras nacionais.empresa.Se queres mercarPaclitaxel API,póñase en contacto connosco en liña.
Hora de publicación: 14-09-2022